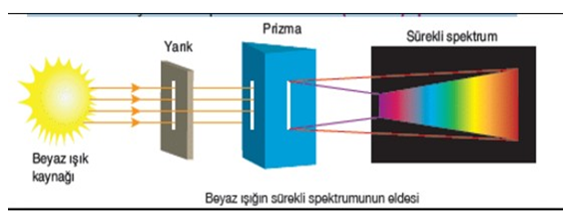
ATOM YAPISI

ÜZÜMLÜ KEK MODELİ
Kek pozitif yüklere, üzümler ise negatif yüklere benzetilmiştir.
Thomson Atom Modeline göre;
MODELİN YETERSİZLİĞİ;

ÇEKİRDEKLİ ATOM MODELİ
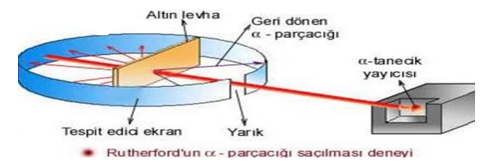
Modelin yetersizliği: Elektronun neden çekirdeğe düşmediği ya da atomdan fırlayıp gitmediği sorusunun cevapsız kalmasıdır.

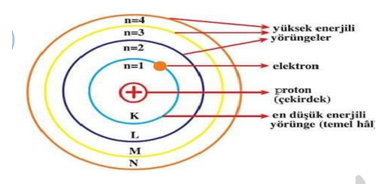
YÖRÜNGELİ ATOM MODELİ
Bohr’a göre;
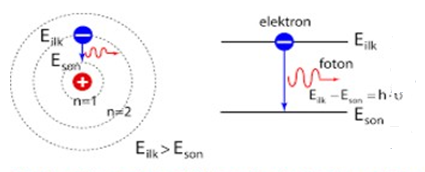
Yüksek enerjili seviyesinden düşük enerji seviyesine atlayan elektron foton salarak enerji yayar.
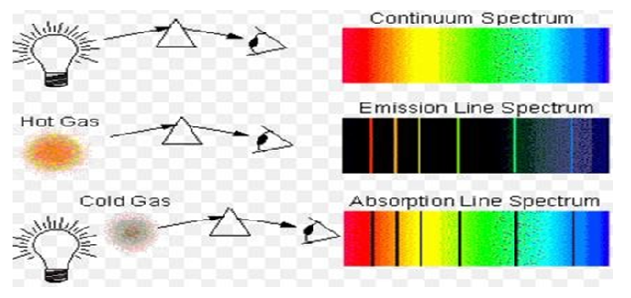
NOT: Atomların ışığı soğurmaları → Absorbsiyon
Atomların ışığı yaymaları → EMİSYON
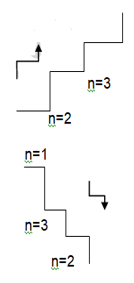
n = 1 den n = 2 ye çıkabilmesi için enerji absorplaması gerekir.
n = 2 den n = 1 e dönerken aradaki enerji farkı kadar ışın yayar.
Havai fişeklerde her rengin oluşmasına farklı bir element yol açar.
BOHR ATOM MODELİNİN YETERSİZLİKLERİ:
Heisenberg ve Schrödinger modern atom teorisini temellerini atan çalışmalar yapmıştır.
ATOM ALTI TANECİKLER
Atom numarası = proton sayısı = çekirdek yükü
Kütle numarası (Nükleon sayısı)=proton sayısı +nötron sayısı
Nötr atom = ps=es İYON YÜKÜ = ps - es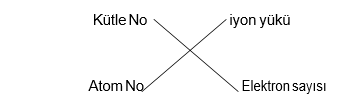
Katyon ps>es
Anyon es>ps
Bir atom iyon duruma geçtiğinde;
Proton sayısı
Çekirdek yapısı DEĞİŞMEZ
Nükleon sayısı
Çekirdeğin çekim gücü
Elektron sayısı
Fiziksel ve kimyasal özellikleri DEĞİŞMEZ
Çap hacmi
Elektron başına uygulanan çekim gücü
NOT: İki atomun
PROTON SAYISI = ELEKTRON SAYISI → KİMYASAL ÖZELLİKLERİ AYNIDIR
PROTON SAYISI =ELEKTRON SAYISI = NÖTRON SAYISI → FİZİKSEL ÖZELLİKLERİ AYNIDIR
İZOTOP ATOM
Örnek: 35Cl 37Cl
OAK =( %1 KNo + %2 Kno)/100
UYARI:
35Cl 37Cl-
PS = 17 PS = 17
ES = 17 ES = 18
Kimyasal özellikleri farklı
İZOTON ATOM
Örnek: 39K 37Cl
İZOBAR ATOM
Örnek: 36Cl 36Ar
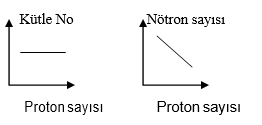
İZOELEKTRONİK ATOM
Örnek: 11Na+1 13Ar+
ALLOTROP
Allotrop Elementlerde;
C(elmas) + O2(g) → CO2(g)
TANECİK |
PROTON SAYISI |
ELEKTRON SAYISI |
X |
20 |
20 |
Y |
35 |
36 |
Z |
8 |
10 |
T |
22 |
18 |
Yukarıdaki tabloda X, Y, Z ve T taneciklerine ait proton ve elektron sayıları verilmiştir. Buna göre, hangi tanecikler anyondur?
A. X ve Y
B. X ve Z
C. Z ve T
D. Y ve Z
E. X ve T
Cevap: D
SORU:
Elektron sayıları eşit olan iki tanecik için,
I. İzoelektroniktir.
II. İzotoptur.
III. Farklı elementlerdir.
Yargılarının doğru olabilmesi için yukarıdaki her öncülde aşağıdaki şartlardan hangileri sağlanmalıdır?
I II III
A. Nötron sayıları aynı Kütle numaraları farklı Çekirdek yükleri aynı
B. Proton sayıları aynı Nötron sayıları farklı Nötr atomlar Proton sayıları farklı
C. Çekirdek yükleri aynı Nötron sayıları aynı Kütle numaraları farklı
D. Yükleri farklı Proton sayıları aynı Nötron sayıları farklı
E. Kütle numaraları aynı Nötron sayıları farklı Proton sayıları farklı
Cevap: B
SORU:
Aşağıdakilerden hangisi Dalton atom modelinde yer almaz?
A. Her elemetin atomlarının farklı olması
B. Elementlerin belli oranlarda birleşerek bileşik oluşturması
C. Atomun içi dolu küreler halinde olmaları
D. Elementlerin doğada izotopları halinde bulunmaları
E. Elementin tüm atomlarının özdeş olması
Cevap: D