KOLİGATİF ÖZELLİKLER :
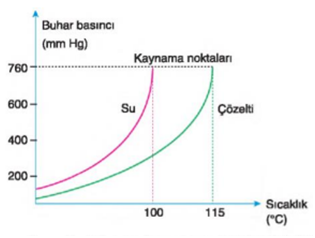
Kaynama Noktası Yükselmesi
Açık bir kapta ısıtılan suyun buhar basıncı gittikçe artar. Bu artış, buhar basıncı ile dış basınç eşit oluncaya kadar sürer. Buhar basıncı dış basınca eşit olunca su kaynamaya başlar.
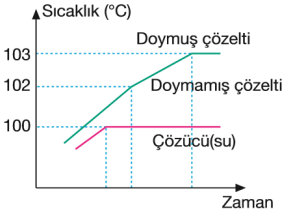
Δtk = Kk.m madde iyonik ise Δtk= Kk.m.İs formülü ile hesaplanır.
Kk: Kaynama noktası yükselme sabiti, m: molalite İs: iyon sayısı, Kk her sıvı için farklıdır.
Donma Noktası Alçalması
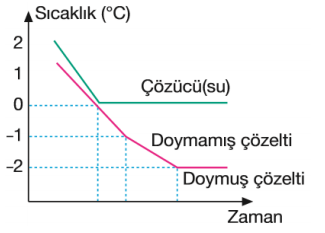
Saf sıvıların, sabit basınçta belli bir donma sıcaklıkları olmasına rağmen çözeltilerin belli bir donma sıcaklıkları yoktur. Çözeltiler saf çözücülerden daha düşük sıcaklıkta donar.
Donma noktası alçalması ölçülerek mol kütlesi belirlenmesi yöntemine kriyoskopi denir.
Ozmos ve Ozmotik Basınç
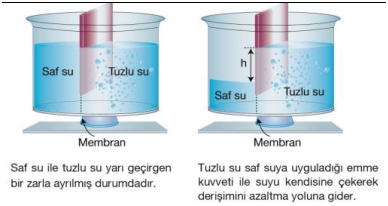
Seyreltik bir çözeltiden daha konsantre bir çözeltiye yarı geçirgen bir zar yardımıyla çözücü moleküllerinin geçişine ozmos olayı denir. Şekilde görüldüğü gibi derişimi fazla olan kısmı, daha seyreltik olan kısma bir emme kuvveti uygular. Bu emme kuvvetine ozmotik basınç denir.
Çözücü moleküllerinin sağ tarafın derişimini azaltmak için zardan diğer tarafa geçmesine ozmos denir.
Eğer iki çözeltinin derişimleri birbirine eşitse aynı ozmotik basınca sahip olurlar ve bunlara izotonik denir.
Eğer iki çözeltinin ozmotik basınçları farklıysa derişimi yüksek olana hipertonik, düşük olana ise hipotonik adı verilir.
Suyun yarı geçirgen bir zar (membran) yardımıyla basınç uygulanarak çok yoğun ortamdan az yoğun ortama geçmesine ters ozmos denir. Ters ozmosta yüksek basınç uygulanarak çözücü (su) elde edilir. Deniz suyundan 30 atm basınçta ters ozmos yöntemiyle içme suyu elde edilir.
Ozmos canlı organizmalar için önemlidir. Çünkü çözünmüş maddelerin hücre içindeki veya dışındaki derişimleri değiştiğinde yarı geçirgen olan hücre zarından su içeri veya dışarı doğru akar. Sonuç olarak hücre şişer veya büzülür. Böylelikle hücrede denge sağlanmış olur.
Hücrenin büzülmesine plazmoliz denir.
Hastalara verilen serumların izotonik çözeltiler olması hastanın sağlığı için önemlidir.
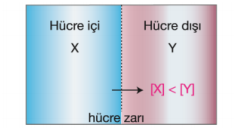
Hüce dışı, hücre içinden daha yoğun ise ozmos olayı hücre dışına olur.
Bu durumda hücre büzülür. Hücrenin büzülmesine plazmoliz denir.
Bu durumda hücre dışı, hücre içine göre hipertonik çözeltidir.
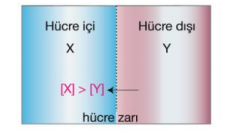
Hücre içi, hücre dışından daha yoğun ise ozmos olayı hücre içine olur.
Bu durumda hücre şişer.Böyle bir çözeltiye hipertonik denir.
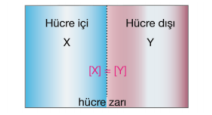
Hücre içi derişimi, hücre dışı derişimine eşit ise çözelti izotonik adını alır.
Ozmos olayı gerçekleşmez. Ancak yoğunluk değişmeyecek şekilde madde giriş çıkışı olur.
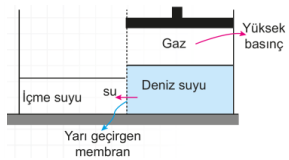
Suyun yarı geçirgen bir membran (zar) yardımıyla daha yoğun bir ortamdan daha az yoğun olan bir ortama geçmesine ters ozmoz denir. Ters ozmozda yüksek basınç kullanılır. Deniz suyunun ozmotik basıncı 30 atm nin üzerine çıkarılırsa ozmoz tersine döner ve deniz suyundan içme suyu elde edilmiş olur. Ters ozmoz olayı atık suların arıtılmasında da kullanılır.